原子力显微镜及其在细胞生物学中的应用
张平城 成英俊 方晔 王中怀 白春礼
(中国科学院化学研究所STM室 北京 100080)
摘要
本文描述了原子力显微镜的基本原理,并对其在成像细胞、细胞器、染色体、细胞膜方面的应用进行了评述,最后还给出了发生在细胞中的动态过程的两个有趣的例子。
关健词
原子力显微镜,细胞,结构,成像,动态学
在细胞生物学发展的历史过程中,显微镜长期以来是其重要的研究工具。扫描隧道显微镜的研制成功是显微学上的一场革命,它导致了一系列扫描探针显微镜[原子力显微镜(AFM)、激光力显微镜(LAFM)、磁力显微镜(MFM)、弹道电子发射显微镜(BEEM)、光子扫描隧道显微镜(PSTM)]的诞生(白春礼等,1992)。这些仪器通过一个探针接近被测物体的表面,从而取得其表面在空间分辨上的某些特性信息。如隧道电流(tunneling current)、相互作用力、离子电导性(ion conductance)、磁场分布等。在这一系列用于生物学研究的仪器中,最有前途的应首推原子力显微镜(Binnig等,1986;Rugar等,1990)。
对于刚性的样品,原子力显微镜通常可以达到原子级分辨率,但对于柔软的生物材料,目前可达到的横向分辨率为1-50 nm,这种仪器有可能在生理缓冲液中对样品成像,并取得其动态数据,因此它在生物学研究中具有诱人的应用前景。除了成像之外,原子力显微镜还有可能实现对生物膜及生物大分子进行操作,并测定各种局域的物理和生物物理性质,可见原子力显微镜对细胞生物学研究的未来发展将有重要影响,下面简述这种新型仪器的简单原理及重要应用。
原子力显微镜的基本工作原理
AFM系统主要由以下几部分组成:(1)带针尖的力敏感元件;(2)力敏感元件运动检测装置;(3)监控力敏感元件运动的反馈回路;(4)扫描系统(一般使用压电陶瓷),其作用是使样品进行扫描运动;(5)图象采集及显示;(6)图象处理系统。其中关键的是前两部分。
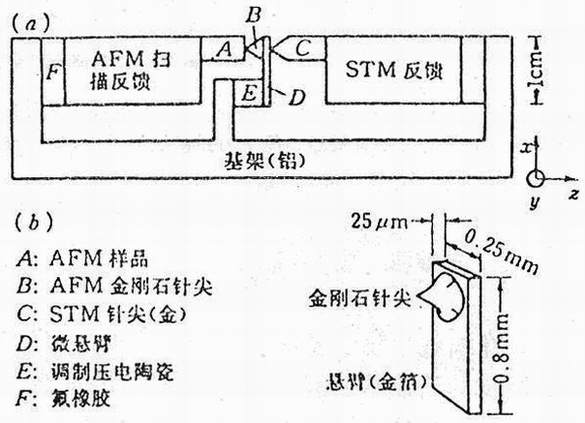
图1. AFM的工作原理示意图
Fig.1 Schematic diagram of AFM working principle
AFM的工作原理如图1所示(Binnig等,1986)。将一个对微弱力极敏感的微悬臂一端固定,另一端有一微小的针尖,针尖与样品表面轻轻接触。使针尖在样品的表面上扫描,由于针尖尖端原子与样品表面原子间存在极微弱的排斥力(10-8—10-6N),如果控制这种力在扫描过程中保持恒定,则微悬臂将在垂直于样品表面的方向上起伏运动,利用隧道电流检测法或光学检测方法,测定微悬臂对应于扫描各点的位置变化,从而可以获得样品表面形貌的信息。
根据AFM 所测力的性质的不同,其工作模式及微悬臂运动的检测方法将有所不同。所谓工作模式,主要是指AFM工作时微悬臂运动所处的状态,主要可分为两种。一种为准静态工作模式,此时针尖与样品的相互作用力较强,微悬臂有较大形变,可用隧道电流法,电容及激光束偏转探测法等直接检测此形变。处于该模式,针尖与样品的间距小于0.03nm,基本上是紧密接触的(故又称接触模式)。由于此时二者电子云发生重叠,导致仪器的分辨率极高,可达原子级水平。运用此种模式可测量原子间的相互作用力,所测最小力可达10-9N。对于针尖与样品间的摩擦力,也可用该模式进行测量,这时最小检测极限可达10-10N。根据反馈方式的不同,该模式又可分成恒力模式和形变变化模式两种。前者反馈信号控制样品上下运动,使得微悬臂的形变及其与样品间的相互作用力保持恒定;后者样品只进行扫描运动,反馈线路控制使得微悬臂随表面的起伏而上下运动。此时,由于反馈直接控制隧道针尖,导致仪器工作稳定,但其数据的解释要困难一些。
上面描述的这种接触模式适应于对硬表面的观察,并可达到较高的分辨率,但这种接触模式与样品表面相互作用较强,对于生物样品,由于它相对于云母,石墨及金等固体材料具有较大的柔软性,目前对其观察还没有达到足够高的分辨率,在针尖扫描时,有时还会造成样品表面的损伤。而对于吸附在坚硬表面的样品(通常为生物大分子),在探针的作用下有时会被移动而不利于成像。对于生物材料,由于其表面较软如果采用接触模式,在不降低其分辨率的情况下,应尽量降低针尖与样品的作用力,以免造成表面损伤。
AFM的另一种工作摸式是动态工作模式。此时微悬臂或样品进行高频振动(一般由压电陶瓷器件产生)。对于微悬臂振动情况,高频振动频率fres接近其固有振动频率。针尖与样品的相互作用力对其间距的变化率F’将影响微悬臂振动频率fref。对于振动较弱的情况,△f = F'fref/2k,其中,k为微悬臂的力常数,F’为针尖与样品的相互作用力对其间距的变化率,振动频率的变化将导致振动幅度出现可测量的变化。因此,测量这个变化可知道F',通过积分就可获得相互作用力的大小。测量振动幅度的变化一般可用内差法或外差法等光学干涉法进行,此时微悬臂振动幅度一般为纳米量级,这就要求针尖与样品间的平均间距必须较大,互相不接触,故该模式又可称为非接触模式。这种模式适合于对细胞类等柔性生物样品的观察,由于针尖距样品较远,与样品表面的相互作用较小,因此对样品造成破坏或发生移动的可能性较小。但同时由于针尖距样品较远的原因,导致以此模式工作的AFM图象横向分辨率降低,达不到原子级水平,一般为纳米级水平。
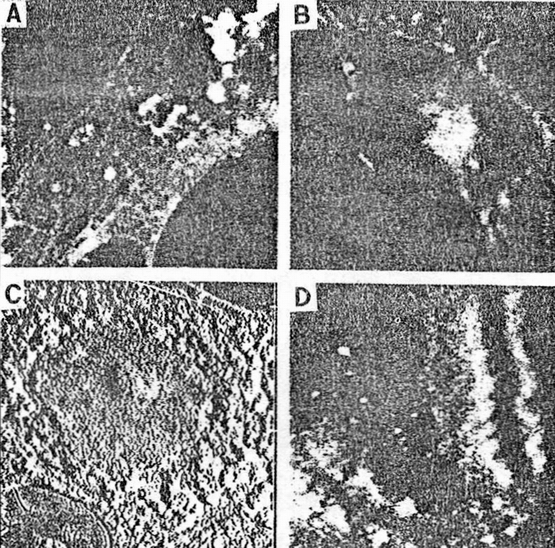
图2 几种细胞的AFM图
Fig.2 AFM image of some cells
A:干燥的心肌细胞质膜所呈现的典型的丝状排列结构(23μm×23μm);
B:生理缓冲液中活的胶质细胞的AFM图象(65μm×65μm);
C:空气中干燥的肌细胞核的AFM图象;
D:来自CHL细胞染色体所呈现的四臂结构及亚结构(10μm×10μm)。
最近本实验室已成功地研制一台激光检测原子力显微镜,并已达到原子级分辨率。关于这台显微镜的详细描述可参见吴浚翰等(1993)的报道。用这台仪器已成功地对烟草花叶病毒(张平城等,1993),波菜叶绿体(Cheng et al.,1993)的结构进行了成像。
用原子力显微镜对细胞进行成像
1.细胞及细胞器的成像
各种固定并干燥的细胞可用AFM来成像。1990年Gould等用原子力显微镜首次观察了在盖玻片上干燥的细胞(Gould等,1990)。他们用原子力显微镜完成了淋巴细胞(一种类型的白血细胞)的检测,并且曾经分辨出细胞中10nm大小的表面结构特征,其样品是通过将抗免疫球蛋白抗体沉积到玻璃基底上得到的。
继Gould等人用原子力显微镜观察了第l个细胞之后,用原子力显微镜对其他多种类型的细胞的研究也已报道(Butt等,1991;Haberle等,1991)。白血细胞、神经细胞及心肌细胞用原子力显微镜已取得较好的图象。细胞内的结构也可以识别(图2:A、B、C)。
Butt等用原子力显微镜对白血细胞进行了成像,在水溶液中的图象可分辨到12nm和特征,而经固定后的红血及白血细胞在缓冲液中成像可以分辨到8nm的结构特征。其图象表明原子力显微镜可以提供在生理条件下细胞表面的高分辨结果。图3是他们得到的白血细胞的图象。
Haberle等人报道了单个活细胞的原子力显微镜研究(Haberle等,1991)。实验过程是在适当的生理条件下,维持细胞具有活性的情况下进行的。他们首次使对红血细胞的观察在该条件下达到10nm的分辨率,这种图象中观察到的结构基本与从干燥细胞观察到的结果相同。
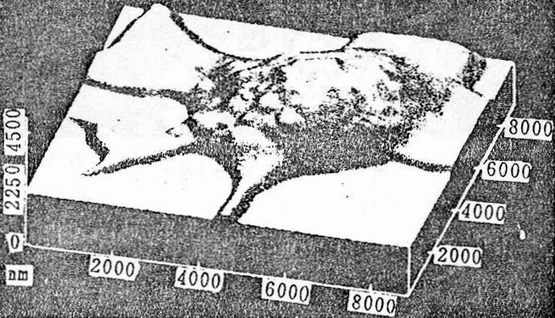
图3 固定化的白血细胞的AFM图象
Fig.3 AFM image of fixed leucocyte
2.染色体的原子力显微图象
新近Putman等人用原子力显微镜获得了整个染色体的图象(图2:D)(Putman等,1992),从图2:D可明显看到,染色体呈X型的“四臂结构”,染色体中的一些亚结构在一定程度上可以被识别.
3.细胞中分子和细胞膜的成像
细胞中的一些蛋白质分子曾经用AFM成像过。其中包括免疫球蛋白(immunoglobulins),血纤维蛋白(fibrin),磷酸化酶(phosphorylase)及肌动纤维(actin)(Drake等,1989;Edstrom等,1990;Weisenhorn等,1990),用AFM可以分辨出一些亚细胞结构。尽管成像作用力、蛋白质运动及脱水作用很可能是影响分辨率的重要因素,但目前蛋白质成像分辨较低的原因仍然很难被完全理解。蛋白质镶嵌在细胞膜上(如离子通道和受体)可能带来一些好处,在这种条件下,蛋白质可以通过膜来支撑。紫膜(purple membranes)上的细菌视紫红质已获得高分辨的图象(Butt等,1990)。Devaud 等在细菌S-层上已检测到蛋白质排列(array)中的缺陷,1991年Hoh等人曾经得到过能彼此分开的一种称为“Gap junction”(缝隙连结)的图象(图4:A、B)(Hoh等,1991)。图象很明显类似于负染色的电镜结果,他们的结果与过去对这种结构的观察结果相比有明显的改善。
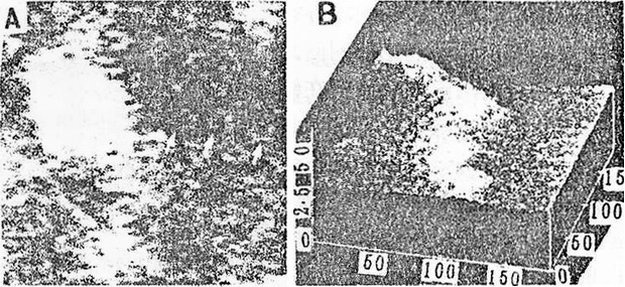
图4 分子和膜的AFM图象
Fig.4 AFM image of molecule and membrane
A:磷酸缓冲液中“gap junction”膜通道细胞外表面的AFM象(80nm×80nm);
B:“gap junction”边缘的表面图象,在通道排列中从右边的磷脂双层到左边的凸起为1—2nm(图中尺寸以nm为单位).
在其他生物分子中,最引人注意的是脂质和核酸。脂质和脂肪酸已在各种人工L-B膜中成像过。单个分子的头部基团(head group)和尾部基团(tail group)已可以分辨。高度结晶化的膜的疏水末端可以在空气中成像(Meyer等,1991),而极性头部基团则要求水环境(Zasadzinski等,1991;Egger 等,1990)。目前,天然膜中单个脂质分子尚未观察到。成像流动体膜中的细节结构是一个重要的问题。
若干年来,有几个研究小组一直致力于用扫描隧道显微镜及原子力显微镜来研究DNA结构的工作,或许能够用来进行DNA的测序。新近,可靠地沉积和成像质粒DNA的方法已取得进展(Bustamnante等,1992,Hansma等,1992),但主要限于在离体的胞外进行的研究。
细胞水平上的动态现象观察
1.病毒穿过细胞膜的动态过程的观察
1992年Haberle等成功地用AFM直接观察到活细胞中发生的生物学过程(Haberle等,1992)。实验是在生理条件下进行的,该实验实现了用AFM在其它技术所不能达到的尺度上进行原位观察。猴肾活细胞在生长条件下进行成像,并可观察到10nm的可重复结构特征。当加入1个牛痘(pox)病毒时,在不同细胞的不同实验中可重复地观察到细胞膜的特征变化。在加入病毒之后,细胞表面立即变软。2h后明显的在细胞膜外长出,然后这种突起又突然消失。图5是他们拍摄到的最为特征的病毒穿过细胞膜的动态过程,这种现象仅在细胞被感染后才观察到。他们将其解释为与病毒繁殖有关的蛋白胞泄过程。

图5. 细胞受到病毒感染约19h后所观察到的胞泄过程
Fig.5 Exocytosis process of cells infected by viruses
一种异常的”指状“(finger立刻)结构可以观察到一个“隆起”(protrusion)在一端出现,约3min后消失
2.细胞生长过程中胞内结构变化观察
新近Henderson等用原子力显微镜成功地观察到活细胞中的纤维状肌动蛋白的形态(Henderson等,1992)。图6是他们所得到的XRL细胞中的细节结构,这是其中的肌动蛋白的原子力显微图象。更有意思的是,他们成功地观察到其中XRL细胞在40min生长过程中的边界及内部F-肌动蛋白的许多形态变化,这些变化如图6所示。斑点可作为静止位置的标记,如在8min时及16min时框图中的箭头所示,在8min的时间间隔内,两根纤维之间的空间增加3μm,根据细胞边缘下面的白色斑点位置,细胞的真正运动可相对地据此来进行确定。
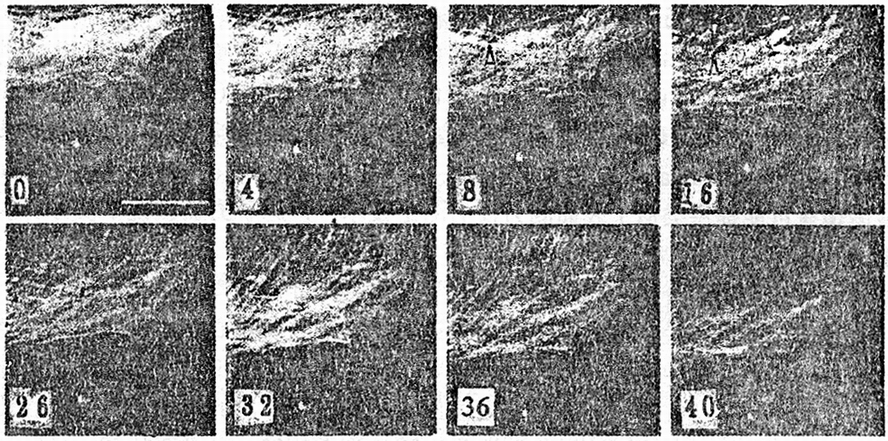
图6. XRL细胞中F-肌动蛋白的AFM图象(标尺=50nm)
Fig.6 AFM image of F-actin in XRL cells(bar=50nm)
现状及展望
原子力显微镜已经在研究细胞、亚细胞水平的结构取得了成功。它可以在大气下对细胞进行成像,并且不用重金属进行覆盖,因此与常规的透射电镜和扫描电镜相比有其优点。但是目前用原子力显微镜来成像细胞结构还没有达到足够高的分辨率。其主要原因可能与生物材料的柔性有关。将样品固定到原子力显微镜可以进行测量的表面上,这仍然是一个值得研究的问题,解决这个问题的一般方法尚待发展。如果要在成像细胞结构或生物分子时仍然保持其功能,则需要在非变性条件下作刚性固定(rigid archoring)。尽管原子力显微镜在研究生物材料方面目前尚未达到尽善尽美的地步,但其潜在的能力具有相当诱人的前景。
原子力显微镜的最突出的功能就是能够实时地跟踪过程,目前原子力显微镜的成像通常需要10—100s,它可以用来观察RNA的翻译或细胞的分裂之类的快速过程。这种能力的有力证明就是对与凝血酶有关的血纤维质的聚合过程的观察(Drake等,1989)。
利用原子力显微镜来进行成像固然是其最重要的用途,可是其他方面的应用也十分重要,尤其是微加工。已经有几个研究组报道,用原子力显微镜可以使蛋白质在云母表面上移动,在人工脂膜上可以制作纳米尺寸的洞穴(Hansma等,1991)。对于由两个并生双层(apposed bilayers)组成的隔开的联结空隙处,用原子力显微镜针尖可以将其中的1个双层切去(Hoh等,1991)。最近,利用AFM,质粒DNA已被剪切成特殊的尺寸而与其序列无关。也许这会产生一些分子克隆或DNA测序的新方法。如果将活性分子如蛋白酶或抗体连接到针尖上,将会使原子力显微镜发展成为超越单纯机械加工的工具,从而用在局域化学或生物化学中(local chemistry and biochemistry)。
当原子力显微镜用1个尖锐的针尖与表面接触时,它使我们不仅可以测定表面的拓扑结构,而且会指出这种作用力特性的问题,关于界面间分子作用力的理解,Israelachvili及其同事已有报道。它使用的是表面测力仪(surface force apparatns)。表面测力仪通过将两个表面靠近并测定相互作用与间距之间的关系,它已被用来检测水合作用及受体(Israelachvili等,1983)-配体间的结合(Leckband等,1992)。原子力显微镜有可能提供类似于表面测力仪的测定技术,但原子力显微镜不仅可以在很小的接触面积上做许多相似的测量,并且带有相当高的空间分辨率(Landman等,1990)。这将会取得细胞膜及分子的许多物理及化学性质的高分辨图谱。
原子力显微镜已经以惊人的速度取得进展,其发明后才6年的时间,就已经在技术科学与材料科学研究中成为人们公认的重要工具。这几年由于物理学家与工程师对仪器研制的贡献,使其从实验室的胚胎中发展成为成像刚性样品的可靠工具。以后几年对于生物学家及生物化学家来说,更好地成像软样品是需要努力的重要任务。
参考文献
- 白春礼,1992,扫描隧道显微镜及其应用,上海科学出版社,91—132。
- 张平城,白春礼,成英俊等,1993,动物学研究,14(增刊):38—41。
- Binnig G, Quate C F, Gerber C. 1986. Phys. Rev. Lett., 56: 930-933.
- Binnig G, Roher H, Gerber C et al. 1992. Phys. Rev. Lett., 49: 57-61.
- Bustamante C, Vesenka J, Tang C L et al. 1992. Biochemistry, 31: 22-26.
- Butt H J, Downing K H, Hansma P K. 1990. Biophys. J., 58: 1251-1258.
- Butt H J, Wolff E K, Gould S A C et al. 1990. J. Struct. Biol., 105: 54-61.
- Drake B et al. 1989. Science, 243: 1586-1589.
- Edstrom R D, Meinke M H, Yang X et al. 1990. Biophys. J., 58: 1437-1448.
- Egger M, Ohnesorge F, Weisenhorn A L et al. 1990. J. Struct. Biol., 103: 89-94.
- Gould S A C, Drake B, Prater C B et al. 1990. J. Vac, Sci. Technol., A 8: 369-373.
- Haberle W, Horber J K H, Binnig G. 1991. J. Vac, Sci, Technol., B 9: 1210-1213.
- Haberle W, Horber J K H, Ohnesorge F et al. 1992. Ultramicroscopy, 42-44: 1161-1167.
- Hansma H G, Gould C, Hansma P K et al. 1991. Langmuir, 7: 1051-1054.
- Hansma H G, Vesenka J, Siegerist C et al. 1992. Science, 256: 1180-1184.
- Henderson E, Haydon P G, Sakaguchi D S. 1992. Science, 257: 1944-1946.
- Hillner P E, Gratz A J, Manne S et al. 1992. Geology, 20: 259-262.
- Hoh J H, Lal R, Johh S A et al. 1991. Science, 253: 1405-1408.
- Israelachvili J N, Pashley R M. 1983. Nature, 306: 249-250.
- Landman U, Luedtke W D, Burnham N A et al. 1990. Science, 248: 454-611.
- Leckband D E, Schmitt F, Knoll W et al. 1992. Science, 255: 1419-1421.
- Meyer E, Honald L, Overner R M et al. 1991. Nature, 349: 398-400.
- Putman C A J, Van der Werf K, De Grooth B G et al. 1992. Rev. Sci. Instrum., 63: 1914-1917.
- Rugar D, Hansma P. 1990. Physics Today, 23-30.
- Weisenhorn A L, Drake B, Prater C B et al. 1990. Biophys. J., 58: 1251-1258.
- Zasadzinski J A N, Helm C A, Longo M L et al. 1991. Biophys. J., 59: 755-760.
- Atomic Force Microscope (AFM) and Aplications in Cell Biology
- Zhang Pingcheng Cheng Yingjun Fang Ye Wang Zhonghuai Bai Chunli
- (Institute of Chemistry, Academia Sinica, Beijing 100080)
- The basic principle of AFM is described here briefly. Applications of AFM in imaging cell, cellular organels, chromosome, cell membrance are reviewed. Two interesting examples about dynamic process taken place in cell are given.
Key words
AFM, Cell, Structure, Imaging, Dynamics
作者简介
白春礼,研究员,国家级有突出贡献的中、青年专家,全国先进工作者。
主要著作有《扫描隧道显微术及其应用》等。先后在国内外学术刊物上发表论文50余篇。研制成功计算机控制的扫描隧道显微镜(STM),获1990年国家科技进步二等奖;继又研制成功我国第一台原子力场显微镜(AFM),获中国科学院1991年科技进步一等奖。“七·五”期间承担中国科学院“重中之重”项目,中国科学院院长基金特别支持项目。“八·五”期间又承担中国科学院“八·五”重大项目——表面、界面和大分子结构的扫描隧道显微学研究。